- Energy education
- сайт для тех, кто хочет изучать энергетику
- Термодинамика и тепломассообмен
- Агрегатное состояние вещества
- 4. hs-диаграмма воды и водяного пара
- Таблицы сухого насыщенного пара
- Блог об энергетике
- энергетика простыми словами
- is (hs)-диаграмма состояния воды и водяного пара
- Описание is-диаграммы
- Как пользоваться is-диаграммой
- H, s-диаграмма
- Содержание
- Создание
- Структура
- Обозначения, принятые в расчётах
- Современные h, s-диаграммы
Energy
education
сайт для тех, кто хочет изучать энергетику
Термодинамика и тепломассообмен
Агрегатное состояние вещества
Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
4. hs-диаграмма воды и водяного пара
При проведении технико-экономических расчётов для подбора оборудования в теплоэнергетике и других отраслях, и моделирования тепловых процессов, необходимы надёжные проверенные данные о теплофизических свойствах воды и водяного пара в широкой области давлений и температур.
Ещё в 1904 году немецкий теплофизик Рихард Молье разработал специальную диаграмму для упрощения и облегчения решений практических задач по теплотехнике, в которой в координатах энтальпии (h) и энтропии (s) графически отображаются сведения из таблиц состояний. s-диаграммы чаще всего содержат в себе данные о свойствах воды в жидком и газообразном состояниях, так как они представляют наибольший интерес с точки зрения теплотехники.
Водяной пар для промышленных целей получают в парогенераторах (паровых котлах) различного типа, общим для которых является то, что процесс получения пара является изобарным. Температура кипения воды и образующегося из нее пара является при этом постоянной, она зависит только от давления парогенератора и называется температурой насыщения $t_н$.
Пар, температура которого равна температуре насыщения, называется насыщенным (пар находится в термодинамическом равновесии с кипящей жидкостью). Насыщенный пар, не содержащий примеси жидкости, называют сухим насыщенным паром. Смесь сухого насыщенного пара и кипящей жидкости называется влажным насыщенным паром. Массовая доля сухого насыщенного пара в этой смеси называется степенью сухости и обозначается x. Для сухого насыщенного пара $x=1$, для кипящей жидкости $x=0$, для влажного насыщенного пара $0 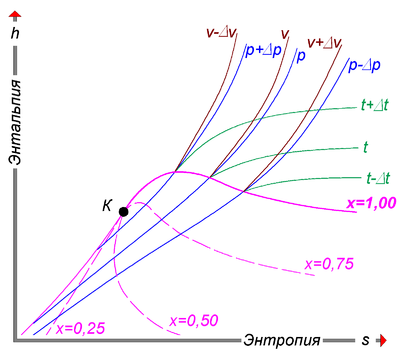
С развитием современной электронно-вычислительной техники и появлением доступных компьютеров и приложений, большое распространение получили hs-диаграммы в электронном виде.
Например симулятор диаграмм HS, TS, PS, PT, PV для воды и водяного пара с расчетом теплофизических свойств по формуляру IAPWS-IF97 и дополнений к нему.
В зависимости от положения курсора (управление мышью и стрелками клавы) выводятся p, T, h, s, v, x выбранной точки. Возможен также ручной ввод данных и перемещения для режимов: p-const, T-const, h-const, s-const, v-const, x-const. В симуляторе присутствует возможность построения и просмотра термодинамических графиков с сохранением в файл. Изменение масштаба — с помощью ползунка или колесика мыши. Данная программа является самым наглядным и удобным способом нахождения термодинамических параметров воды и водяного пара, к тому же она бесплатная. Официальный сайт программы
Администратор сайта: Колосов Михаил
email:
Copyright © 2011-2021. All rights reserved.
Источник статьи: http://www.energyed.ru/Term/PhaseCh04
Таблицы сухого насыщенного пара
Для нахождения параметров сухого пара ts, v”, h” и прочих практически пользуются вместо приведенных в предыдущем разделе формул (в некоторых случаях приближенных) специальными таблицами, в которых приводятся готовые значения этих параметров, вычисленные на основании опытов и теоретических исследований.
Таких таблиц было предложено несколько. В настоящее время широкой известностью пользуются таблицы Теплофизических свойств воды и водяного пара, составленные С.Л. Ривкиным и А.А. Александровым или А.А. Александровым, Б.А. Григорьевым (рис. 6.1)
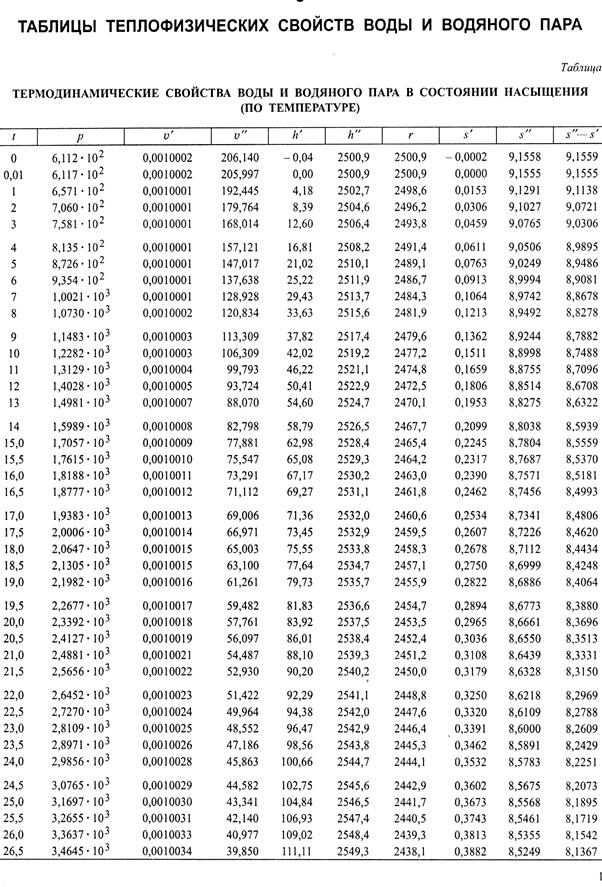
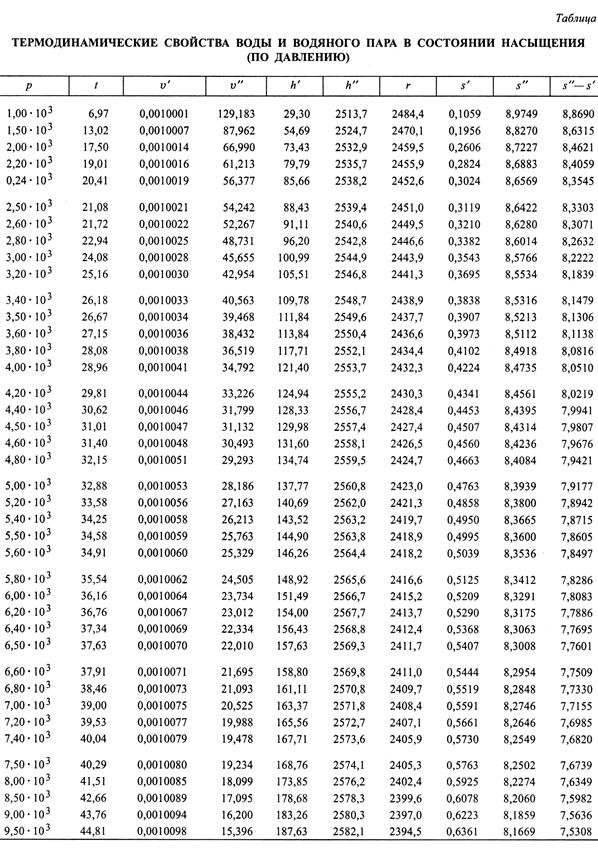
В издании А.А. Александрова и Б.А. Григорьева 2006 г. приведены девять таблиц (табл. I–IX). В табл. I (рис. 6.2) приведены термодинами-ческие свойства воды и водяного пара в состоянии насыщения (по температурам). В первом столбце таблицы указаны температуры пара, расположенные в порядке возрастания от 0 до 374 о С; в остальных столбцах приведены соответствующие им значения параметров кипящей воды и сухого насыщенного пара. В табл. II (рис. 6.3) приведены термоди-намические свойства воды и водяного пара в состоянии насыщения (по давлениям). В первом столбце таблицы указаны абсолютные давления пара, расположенные также в порядке их возрастания, начиная от 1,00 ∙ 10 3 Па и до 2,21∙ 10 7 Па, а в остальных столбцах приведены соответствующие им значения параметров кипящей воды и сухого насыщенного пара.
В тех случаях, когда требуется найти значение какого-либо из приве-денных в таблицах параметров для промежуточных значений температур и давлений, прибегают к интерполированию. Из табл. I и II видно, что с увеличением температуры и, следовательно, давления удельный объем жидкости v’ увеличивается (весьма незначительно), а удельный объем сухого пара v” уменьшается. При критическом значении температуры
vp – координат и провести через полученные таким путем точки кривые,
то получим диаграмму, подобную изображенной на рис. 5.3.
Рис. 6.1. Обложка таблицы теплофизических свойств воды и водяного пара
Рис. 6.2. Термодинамические свойства воды и водяного пара в состоянии насыщения
Рис. 6.3. Термодинамические свойства воды и водяного пара в состоянии насыщения
Интересное свойство водяных паров обнаруживается при рассмот-рении характера изменения величины энтальпии в зависимости от давления пара (колонка 6 в табл. II рис. 6.3).
Как видим, при давлении 1,00 ∙ 10 3 Па h”= 2513,7 кДж/кг. С увели-чением давления энтальпия увеличивается, достигая для давления 3,80 ∙ 10 6 Па максимального значения h”= 2801,8 кДж/кг, а затем постепенно умень-шается до 2087,5 кДж/кг при давлении 2,21 ∙ 10 7 Па. Таким образом, оказывается, что для получения сухого пара давлением, предположим, в 10 МПа, требуется подвести к нему меньше теплоты, чем для пара в 1 МПа (в первом случае h”= 2725 кДж/кг, а во втором h” = 2777 кДж/кг). В то же время пар давлением в 10 МПа способен совершать гораздо большую механическую работу, чем пар давлением в 1 МПа. Это свойство водяных паров является одной из причин, заставляющих стремиться к внедрению в промышленность и энергетику пара высокого давления.
Дата добавления: 2015-04-21 ; просмотров: 2457 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник статьи: http://helpiks.org/3-26544.html
Блог об энергетике
энергетика простыми словами
is (hs)-диаграмма состояния воды и водяного пара
Размер: 3070х3995 пикселей
Форматы: .PDF, .JPG
Диаграмма цветная — степени сухости, температура, давление и объем выделены разными цветами, что делает работу с диаграммой очень удобной.
Большой размер позволит распечатать диаграмму на формате А3 и больше.
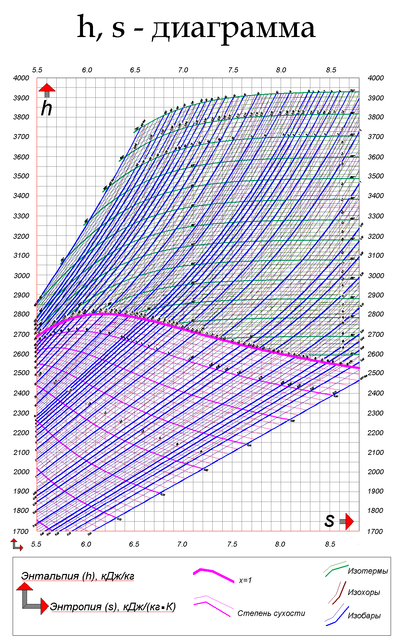
is-диаграмма применяется для практических расчетов процессов водяного пара. На ней теплота и энтальпия измеряются линейными отрезками.
is-диаграмма обладает рядом важных свойств: по ней можно быстро определить параметры пара и разность энтальпий в виде отрезков, наглядно изобразить адиабатный процесс, и решать другие задачи.
Так же вы можете использовать очень удобную и наглядную программу.
Описание is-диаграммы
На is-диаграмме изображены термодинамические процессы:
- Изобарный процесс (p = const) — фиолетовые линии (изобары),
- Изотермический процесс (t = const) — зеленые линии (изотермы),
- Изохорный процесс (v = const) — красные линии (изохоры).
Степень сухости и паросодержание (х) — розовые линии. Жирная розовая линия — степень сухости х=1. Все что ниже этой линии — зона влажного пара.
Ось «Х» — энтропия, ось «Y» — энтальпия.
Семейство изобар в области насыщения представляет собой пучок расходящихся прямых, начинающихся на нижней и оканчивающихся на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой.
В i, s-диаграмме водяного пара наносятся также линии постоянного паросодержания (x = const) и линии постоянного удельного объема (v = const). Изохоры идут несколько круче, чем изобары.
Состояние перегретого пара обычно определяется в технике давлением p и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением p и паросодержанием x.
Точка, изображающее это состояние, определяется пересечением изобары и линии x = const.
Как пользоваться is-диаграммой
Для описания воспользуемся небольшой задачей. Возьмем с потолка условие.
Пусть начальные параметры пара будут: давление пара р = 120 бар, температура пара t = 550°С. Пар адиабатно расширяется в турбине до температуры, например, 400 °С.
Для примера этого будет достаточно.
Адиабатный процесс на is-диаграмме — это вертикальная линия (горизонтальная линия — дросселирование). Это для справки.
Итак, начальное давление и температура у нас есть. Найдем эту точку на is-диаграмме:
Нам нужна изобара, соответствующая давлению 120 бар и изотерма, соответствующая температуре 550 °С. На их пересечении и будет точка, соответствующая начальным параметрам пара в нашей задаче.
Найдя эту точку, мы уже можем определить в ней энтальпию и энтропию. Опустив на оси проекции найденной точки, узнаем значения энтальпии (ось «Y») и энтропии (ось «Х»).
3480 кДж/кг, S = 6,65 кДж/(кг•К)
Далее нам нужно узнать параметры пара после адиабатного расширения. Мы знаем, что по поставленным нами условиям, пар расширился и его температура в точке 2 = 400 °С. Я уже упоминал, что на is-диаграмме адиабатный процесс изображается в виде вертикальной линии. Проведем эту линию из точки 1 (начальные параметры) до пересечения с изотермой 400 °С.
Получена точка 2. Через эту точку проходит изобара. Она соответствует давлению 50 бар. Энтропия у нас не изменилась, так как процесс адиабатный, а вот энтальпия стала равна i = 3200 кДж/кг.
Вот и все. Дальше остаются только расчеты: определение изменения внутренней энергии (Δu), работы (l, l’) и т. д. Все это считается по формулам (формулы можете найти в статье «Основные термодинамические процессы»), а значения и график процесса расширения пара у вас уже есть.
Источник статьи: http://energoworld.ru/theory/is-diagramma-sostoyaniya-vody-i-vodyanogo-para/
H, s-диаграмма
H, s-диагра́мма (чит. «аш-эс-диаграмма») (написание строчными буквами: «h, s-диаграмма», ранее i, s-диаграмма, также — диаграмма Молье) — диаграмма теплофизических свойств жидкости и газа (в основном воды и водяного пара), показывающая характер изменения различных свойств, в зависимости от параметров состояния. В основном большое применение получили h, s-диаграммы воды и водяного пара, так как в качестве рабочего тела в теплотехнике чаще всего применяются именно вода и водяной пар, из-за их сравнительной дешевизны и доступности, причём наиболее пристальное внимание оказывается именно той части диаграммы, в которой вода в парообразном состоянии, так как в жидком состоянии она практически несжимаема.
Содержание
Создание
При проведении технико-экономических расчётов для подбора оборудования в теплоэнергетике и других отраслях, и моделирования тепловых процессов, необходимы надёжные проверенные данные о теплофизических свойствах воды и водяного пара в широкой области давлений и температур.
Многолетнее международное сотрудничество в области исследования свойств воды и водяного пара, позволило разработать и внедрить международные нормативные материалы, содержащие уравнения для описания различных свойств, в специальные таблицы. На основании этих уравнений, соответствующих требованиям Международной системы уравнений для научного и общего применения (The IFC Formulation for Scientific and Generale Use), были составлены и опубликованы подробные таблицы теплофизических свойств воды и водяного пара, которые широко применяются в практике инженерных теплотехнических расчётов. Данные, полученные путём расчёта по международным уравнениям, были приняты и в СССР, и получили определение таблиц термодинамических свойств воды и водяного пара. В них также включили данные по динамической вязкости.
Ещё в 1904 году немецкий теплофизик Рихард Молье разработал специальную диаграмму для упрощения и облегчения решений практических задач по теплотехнике, в которой в координатах энтальпии (h) и энтропии (s) графически отображаются сведения из таблиц состояний. В 1906 году в Берлине была издана его книга «Новые таблицы и диаграммы для водяного пара». Впоследствии такая диаграмма получила название Диаграмма Молье. В СССР некоторое время было принято название i, s-диаграмма, а в настоящее время — h, s-диаграмма.
Структура
H, s-диаграммы чаще всего содержат в себе данные о свойствах воды в жидком и газообразном состояниях, так как они представляют наибольший интерес с точки зрения теплотехники.
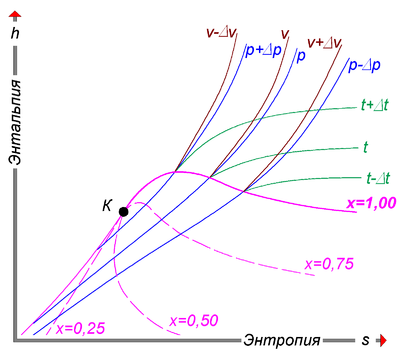
- Степень сухости — это параметр, показывающий массовую долю насыщенного пара в смеси воды и водяного пара. Значение x = 0 соответствует воде в момент кипения (насыщения). Значение х = 1, показывает, что в смеси присутствует только пар. При нанесении соответствующих точек в координатах (h,s), взятых из таблиц насыщения справочников свойств воды и водяного пара, при их соединении получаются кривые, соответствующие определённым степеням сухости. В таком случае, линия х = 0 является нижней пограничной кривой, а х = 1 — верхней пограничной кривой. Область, заключённая между этими кривыми, является областью влажного пара. Область ниже кривой х = 0, которая стягивается практически в прямую линию (не показана), соответствует воде. Область выше кривой х = 1 — соответствует состоянию перегретого пара.
- Критическая точка (К). При определённом, достаточно высоком давлении, называемом критическим, свойства воды и пара становятся идентичными. То есть исчезают физические различия между жидким и газообразным состояниями вещества. Такое состояние называют критическим состоянием вещества, которому соответствует положение критической точки. Следует заметить, что она на пограничной кривой лежит гораздо левее максимума этой кривой.
- Изотерма — изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённой температуре. Изотермы пересекают пограничные кривые с изломом и, по мере удаления от верхней пограничной кривой, асимптотически приближаются к горизонтали. На схеме для упрощения представлены только три изотермы:
- t + Δt;
- t;
- t — Δt.
- Изобара — изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённому давлению. Изобары не имеют изломов при пересечении пограничных кривых. На схеме представлены только три изобары:
- p + Δp;
- p;
- p — Δp.
- Изохора — изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённому объёму. Изохоры на h, s-диаграмме в области перегретого пара, всегда проходит круче, чем изобары, и это облегчает их распознавание на одноцветных диаграммах. Построение изохор требует более кропотливой работы с таблицей состояний. На схеме представлены только три изохоры:
- v — Δv;
- v;
- v + Δv.
Изотермы и изобары в области влажного пара совпадают по причине линейной зависимости в состоянии насыщения.
Обозначения, принятые в расчётах
- P — абсолютное давление (бар);
- t — температура (градусы Цельсия);
- h — удельная энтальпия (кДж/кг);
- s — удельная энтропия (кДж/(кг·К));
- v — удельный объём (м³/кг);
- x — степень сухости;
- ts — температура насыщения (градусы Цельсия);
- h’ — удельная энтальпия кипящей воды (кДж/кг);
- h’ ‘ — удельная энтальпия сухого насыщенного пара (кДж/кг);
- v’ — удельный объём кипящей воды (м³/кг);
- v’ ‘ — удельный объём сухого насыщенного пара (м³/кг);
- s’ — удельная энтропия кипящей воды (кДж/(кг·К));
- s’ ‘ — удельная энтропия сухого насыщенного пара (кДж/(кг·К));
- Точка «0» — начальная точка процесса расширения (сжатия) пара;
- Точка «1t» — конечная точка расширения (сжатия) в идеальном процессе;
- Точка «1» — конечная точка расширения (сжатия) в реальном процессе с заданным к.п.д.;
- H0=h0— h1t;
- H=h0 — h1.
Современные h, s-диаграммы
С развитием современной электронно-вычислительной техники и появлением доступных компьютеров и приложений, большое распространение получили h, s-диаграммы в электронном виде. Такие диаграммы представляют собой обычный оконный интерфейс с полями для ввода исходных данных, графическими функциональными клавишами, и полем ответов. После ввода имеющихся данных, нажатием графической клавиши «Расчёт» или «Ввод» на клавиатуре компьютера можно вызвать необходимую информацию при условии соблюдения введённых параметров.
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/1431877