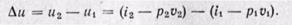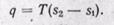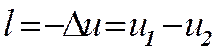Изобарный процесс для влажного пара
Для расчета процессов изменения состояния водяного пара не используются имеющиеся для него уравнения состояния, ввиду их сложности и ограничений применимости в зависимости от области параметров состояния водяного пара (в различных областях используются различные уравнения). Применение таких уравнений оправдано, когда они заложены в современные ЭВМ, и машина сама считает параметры по любой известной паре параметров по специальной программе.
Практически расчет процессов изменения состояния воды и водяного пара осуществляется с использованием таблиц их термодинамических свойств и диаграмм. Из диаграмм наибольшее применение нашли h,s- диаграммы.
Наиболее простым и наглядным является метод расчета паровых процессов с использованием h,s- диаграммы. Здесь не нужно выяснять, в какой области протекает процесс, есть ли переход из зоны перегретого пара в зону влажного пара или наоборот. Все это видно по графику процесса. Расчет сводится к чтению диаграммы и, в случае надобности, к подсчету по полученным из диаграммы данным работы, теплоты и изменений параметров и функций состояния. В случае, когда процесс выходит за пределы рабочей h,s- диаграммы, расчет проводится с использованием таблиц термодинамических свойств воды и водяного пара.
Диаграммы Р,v и T,s служат для иллюстрации особенностей процессов и могут быть применены для графического изображения в виде площадей энергетических величин q, l, D u , характеризующих данный процесс.
В практике теплоэнергетики наиболее часто встречаются: изохорный процесс (растопка котла при повышении давления), изобарный процесс (установившийся режим работы котла, процессы в подогревателях и конденсаторах пара), адиабатный процесс (в паровой турбине и насосе), изотермический процесс (испарение воды в реакторе кипящего типа).
Рассмотрим подробно эти процессы, считая их обратимыми.
Адиабатный процесс
В тепловых машинах, таких как турбина или насос, процесс протекает очень быстро и теплообмен с внешней средой очень незначителен, им можно пренебречь. Поэтому обратимым процессом в таких машинах является идеальная адиабата (изоэнтропа).
На рис. 7.24, 7.25, 7.26 изображен обратимый адиабатный процесс расширения пара 1-2 в Р,v-, T,s- и h,s- диаграммах.
В Р,v- диаграмме адиабата представляет собой кривую гиперболического характера с переменным показателем адиабаты «к». Необходимо отметить, что показатель адиабаты «к» для воды и пара никакого отношения к коэффициенту Пуассона cP/cV не имеет. Он рассчитывается только по параметрам обратимого адиабатного процесса вблизи какой — либо фиксированной точки по формуле
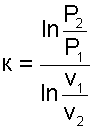 |
 |
то работа расширения адиабатного процесса равна изменению внутренней энергии с обратным знаком и может быть подсчитана как
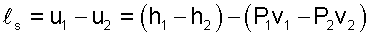 |
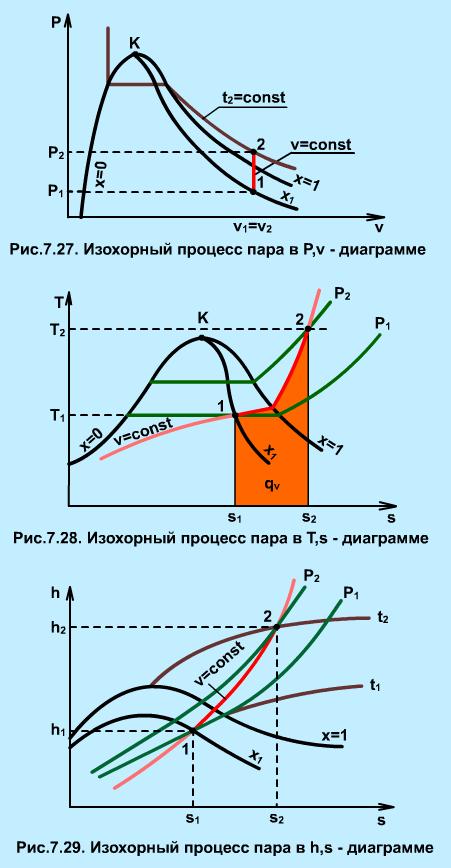 |
В Р,v- диаграмме изохора 1-2 — вертикальная прямая (рис.7.27). Работа расширения в изохорном процессе равна нулю (dl=Рdv, dv=0, lV= 0). Теплота изохорного процесса расходуется только на увеличение внутренней энергии пара:
 |
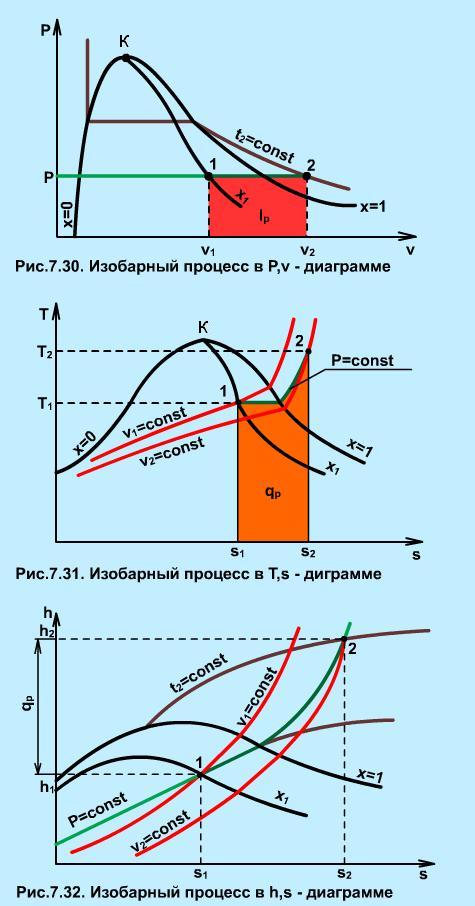 |
В диаграмме Р,v изобара представляет горизонтальную прямую 1-2 (рис. 7.30), площадь под которой соответствует работе расширения, определяемой по формуле
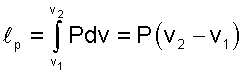 |
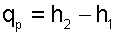 |
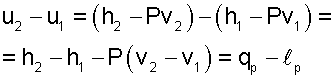 |
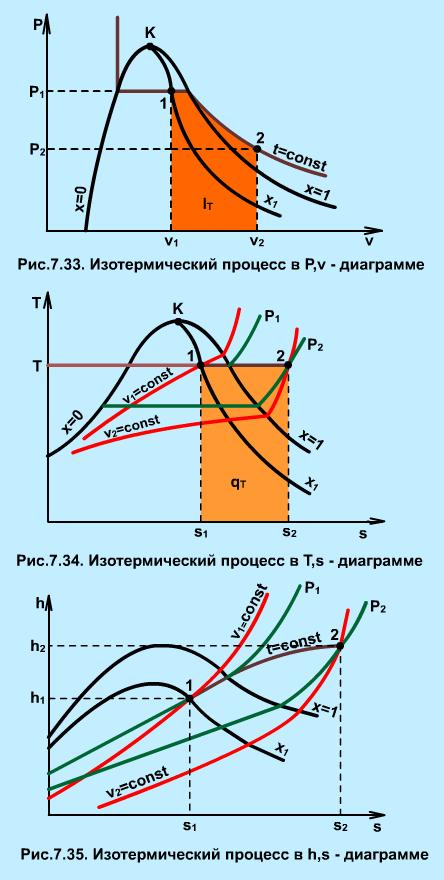 |
Работа расширения изотермического процесса изображается площадью под процессом 1-2 в Р,v- координатах (рис. 7.33) и рассчитывается исходя из первого закона термодинамики:
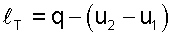 |
 |
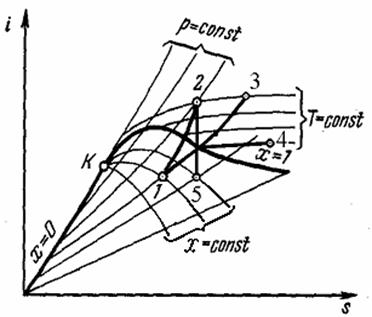 |
| Рис. Термодинамические процессы водяного пара на i, s-диаграмме: 1 – 2 – изохорный процесс, 1 – 3 — изобарный процесс, 1 – 4 — изотермный процесс, 2 – 5 – адиабатный процесс |
Для анализа работы паросиловых установок существенное значение имеют изохорный, изобарный, изотермический и адиабатный процессы. Политропные процессы не рассматриваются, т.к. водяной пар не соответствует свойствам идеального газа.
Термодинамические процессы водяного пара очень наглядно изображаются на i, s-диаграмме (рис). Процесс = горизонтальная прямая. Для удобства нанесены линии равных давлений, температур и степеней сухости. На рис. показано протекание изохорного, изобарного, изотермического и адиабатного процессов на i, s-диаграмме. Следует обратить внимание, что в области влажного пара линии изобар и изотерм совпадают.
По i, s-диаграмме можно выполнить приближённые расчеты этих процессов, поскольку значения подлежащих определению параметров считываются непосредственно с диаграммы.
Общий метод расчета по i, s-диаграмме состоит в следующем. По известным параметрам наносится начальное состояние рабочего тела, затем проводится линия процесса и определяются его параметры в конечном состоянии. Далее вычисляется изменение внутренней энергии, определяются количества теплоты и работы в заданном процессе.
Точные расчёты проводятся с помощью таблиц воды и водяного пара. При расчётах важно знать в какой зоне находятся начальные и конечные значения параметров. Это удобно определять на Т – s диаграмме. Из диаграммы Т – s видно, что количество теплоты равно площади под кривой процесса.
Для любой точки на Т — s-диаграмме
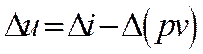
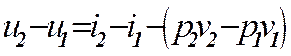
 |
| Рис. 4.9\ Изохорный процесс водяного пара на Т – s — диаграмме |
Изохорный процесс(рис. 4.9).
Из рисунка видно, что нагреванием при постоянном объеме влажный пар можно перевести в сухой насыщенный и перегретый. Охлаждением его можно сконденсировать, но не до конца, так как при каком угодно низком давлении над жидкостью всегда находится некоторое количество насыщенного пара. Это означает, что изохора не пересекает нижнюю пограничную кривую.
В изохорном процессе работа
поэтому подведенная теплота расходуется (в соответствии с первым законом термодинамики 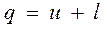
 |
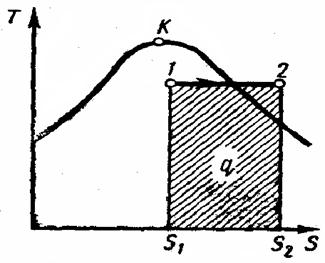
| Р»с. 4.10. Изобарный процесс водяного пара на Т – s — диаграмме |
Изобарный процесс (рис. 4.10).
При подводе теплоты к влажному насыщенномy пару его степень сухости увеличится и он (при постоянной в этой области температуре) переходит в сухой, а при дальнейшем подводе теплоты — в перегретый пар (температура пара при этом растет). При отводе теплоты влажный пар конденсируется при Ts = const. Полученная в процессе теплота рав-разности энтальпий:
Работа процесса подсчитывается по формуле
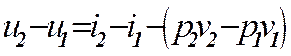
 |
| Рис. 4.11. Изотермический процесс водяного пара на Т –s -диаграмме |
Изотермный процесс (рис. 4.11). Внутренняя энергия водяного пара в процессе Т = const не остается постоянной (как у идеального газа), так как изменяется ее потенциальная составляющая.
Количество полученной в изотермическом процессе теплоты равно
Работа расширения определяется из первого закона термодинамики:
Величина Δu находится по формуле
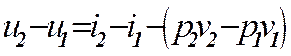
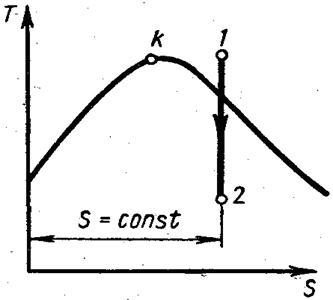 |
| Рис. 4.12. Адиабатный процесс водяного пара на Т – s — диаграмме |
Адиабатный процесс (рис. 4.12).
При адиабатном расширении давление и температура пара уменьшаются и перегретый пар становится сначала сухим, а затем влажным.
Работа адиабатного процесса определяется выражением
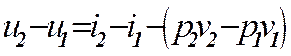
В области перегретого пара k = 1.3, в области влажного пара, включая верхнюю и нижнюю пограничные кривые k = 1,035+0,1 х.
Источник статьи: http://studopedia.ru/3_34767_osnovnie-termodinamicheskie-protsessi-vodyanogo-para.html

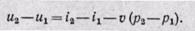
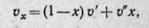 откуда
откуда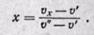 (12-6)
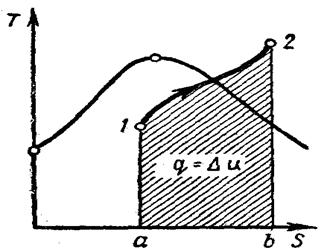
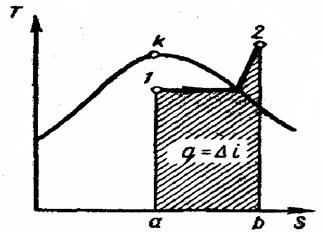
(12-6)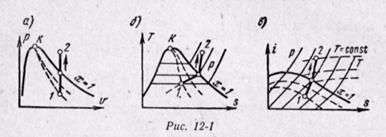 Изобарный процесс. На is-диаграмме изобара в области насыщенного пара представляется прямой линией, пересекающей нижнюю, и верхнюю пограничные кривые. При подводе теплоты к влажному пару степень сухости его увеличивается и он (при постоянной температуре) переходит в сухой, а при дальнейшем подводе теплоты в перегретый пар. Изобара в области перегретого пара представляет собой кривую, направленную выпуклостью вниз (рис. 12-2, а).
Изобарный процесс. На is-диаграмме изобара в области насыщенного пара представляется прямой линией, пересекающей нижнюю, и верхнюю пограничные кривые. При подводе теплоты к влажному пару степень сухости его увеличивается и он (при постоянной температуре) переходит в сухой, а при дальнейшем подводе теплоты в перегретый пар. Изобара в области перегретого пара представляет собой кривую, направленную выпуклостью вниз (рис. 12-2, а).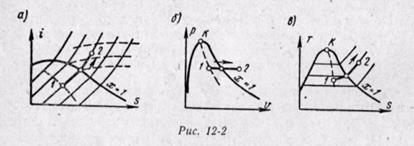
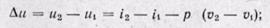
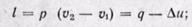
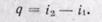
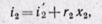 (12-7)
(12-7)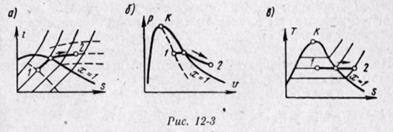
 \
\