- Как пользоваться hs-диаграммой
- Диаграммы водяного пара
- Диаграммы воды и водяного пара
- Смотреть видео как работать с таблицей воды и водяного пара
- Схема кислотности
- Таблица по жесткости
- Блог об энергетике
- энергетика простыми словами
- is (hs)-диаграмма состояния воды и водяного пара
- Описание is-диаграммы
- Как пользоваться is-диаграммой
Как пользоваться hs-диаграммой
Описание hs-диаграммы
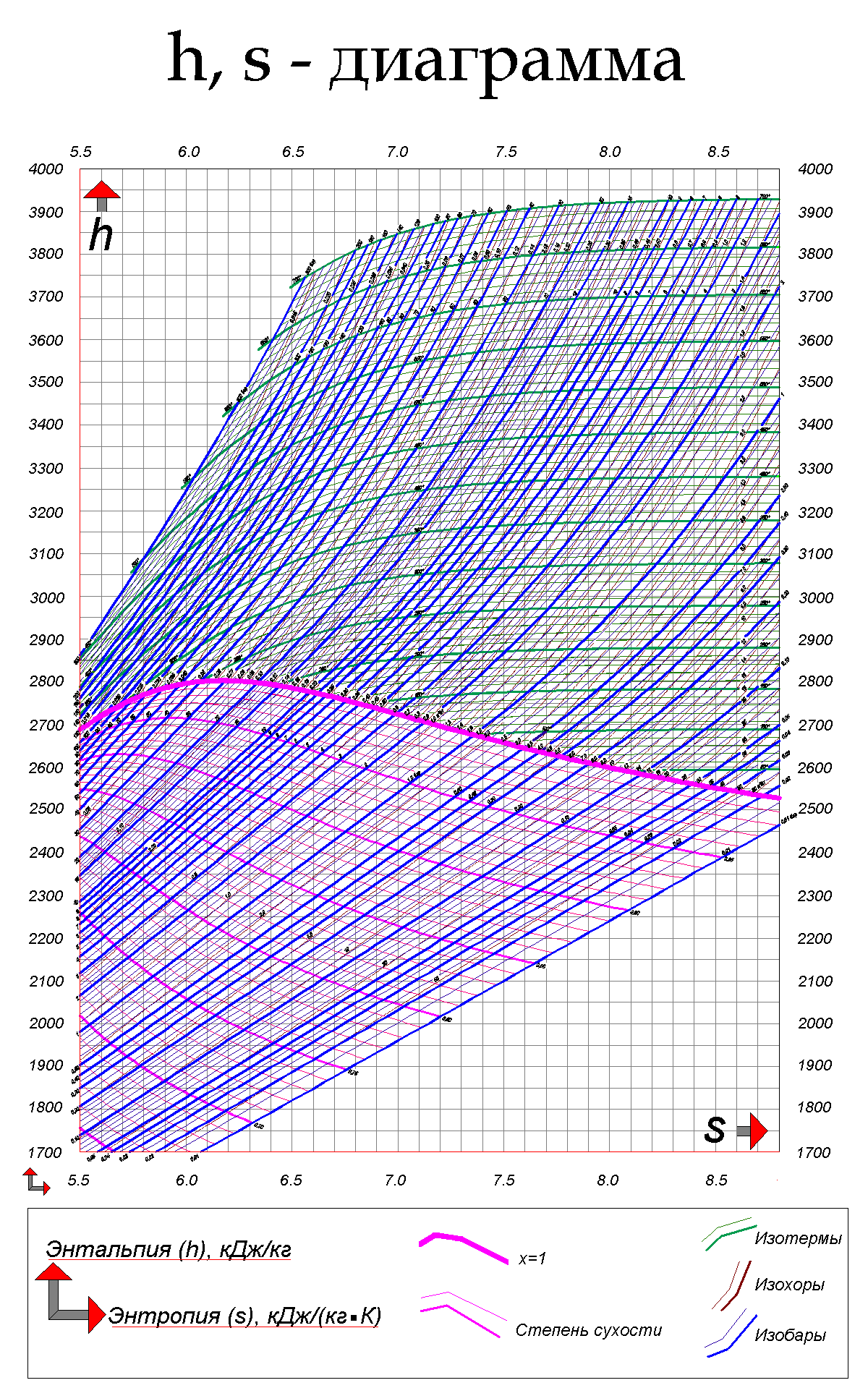
На hs-диаграмме изображены термодинамические процессы:
§ Изобарный процесс (p = const) — фиолетовые линии (изобары),
§ Изотермический процесс (t = const) — зеленые линии (изотермы),
§ Изохорный процесс (v = const) — красные линии (изохоры).
Степень сухости и паросодержание (х) — розовые линии. Жирная розовая линия — степень сухости х=1. Все что ниже этой линии — зона влажного пара.
Ось «Х» — энтропия, ось «h» — энтальпия.
Семейство изобар в области насыщения представляет собой пучок расходящихся прямых, начинающихся на нижней и оканчивающихся на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой.
В i, s-диаграмме водяного пара наносятся также линии постоянного паросодержания (x = const) и линии постоянного удельного объема (v = const). Изохоры идут несколько круче, чем изобары.
Состояние перегретого пара обычно определяется в технике давлением p и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением p и паросодержанием x.
Точка, изображающее это состояние, определяется пересечением изобары и линии x = const.
Критические параметры водяного пара: tкр = 364,15 0 С, vкр = 0, 00326 м 3 /кг, ркр = 22, 129 МПа.
Как пользоваться hs-диаграммой
Для описания воспользуемся небольшой задачей. Возьмем с потолка условие.
Пусть начальные параметры пара будут: давление пара р = 120 бар, температура пара t = 550°С. Пар адиабатно расширяется в турбине до температуры, например, 400 °С.
Для примера этого будет достаточно.
Адиабатный процесс на hs-диаграмме — это вертикальная линия (горизонтальная линия — дросселирование). Это для справки.
Итак, начальное давление и температура у нас есть. Найдем эту точку на hs-диаграмме:
Нам нужна изобара, соответствующая давлению 120 бар и изотерма, соответствующая температуре 550 °С. На их пересечении и будет точка, соответствующая начальным параметрам пара в нашей задаче.
Найдя эту точку, мы уже можем определить в ней энтальпию и энтропию. Опустив на оси проекции найденной точки, узнаем значения энтальпии (ось «Y») и энтропии (ось «Х»).
3480 кДж/кг, S = 6,65 кДж/(кг•К)
Далее нам нужно узнать параметры пара после адиабатного расширения. Мы знаем, что по поставленным нами условиям, пар расширился и его температура в точке 2 = 400 °С. Я уже упоминал, что на is-диаграмме адиабатный процесс изображается в виде вертикальной линии. Проведем эту линию из точки 1 (начальные параметры) до пересечения с изотермой 400 °С.
Полученаточка 2. Через эту точку проходит изобара. Она соответствует давлению 50 бар. Энтропия у нас не изменилась, так как процесс адиабатный, а вот энтальпия стала равна i = 3200 кДж/кг.
Вот и все. Дальше остаются только расчеты: определение изменения внутренней энергии (Δu), работы (l, l’) и т. д. Все это считается по формулам, а значения и график процесса расширения пара у вас уже есть.
Источник статьи: http://poisk-ru.ru/s2742t3.html
Диаграммы водяного пара
Здравствуйте! Определять параметры и функции состояния по формулам зачастую бывает затруднительно вследствие сложной зависимости теплоемкости водяного пара и теплоты парообразования от температуры и давления. Поэтому для водяного пара, на основании экспериментальных исследований составлены таблицы, отражающие зависимости важнейших параметров водяного пара. Пользуясь ими, к примеру, по известному давлению сухого насыщенного пара можно определить все остальные параметры.
Так как состояние сухого насыщенного пара однозначно определяется его давлением р или температурой насыщения Тн, то таблицы составляются по давлению или температуре. По одному из этих параметров из таблиц можно определить другие величины, характеризующие состояние сухого насыщенного пара. В таблицах перегретого пара приводятся его параметры и функции состояния в зависимости от температуры и давления пара.
Расчет процессов изменения состояния пара упрощается при переходе к графическому методу, основанному на использовании диаграмм состояния. В этом случае не требуется проводить большой объем вычислений и расчет сводится к определению параметров с помощью диаграмм. Графическим методом легко определить не только начальные и конечные параметры пара в процессе, но и все промежуточные параметры состояния, что существенно упрощает инженерные расчеты.
Преимуществом графического метода является возможность сравнительно просто проследить связь между различными величинами, это делает его незаменимым при теоретическом анализе различных процессов в тепловых двигателях. С помощью диаграммы, как и по таблицам, можно определить параметры и функции состояния водяного пара, в том числе и влажного насыщенного пара.
Наибольшее распространение получили Ts- и is-диаграммы состояния водяного пара. Так как с помощью Ts-диаграммы легко определить количество теплоты в процессе, то она и применяется в основном для теоретического анализа экономичности тепловых двигателей. При расчетах различных процессов изменения состояния используется главным образом is- диаграмма водяного пара.
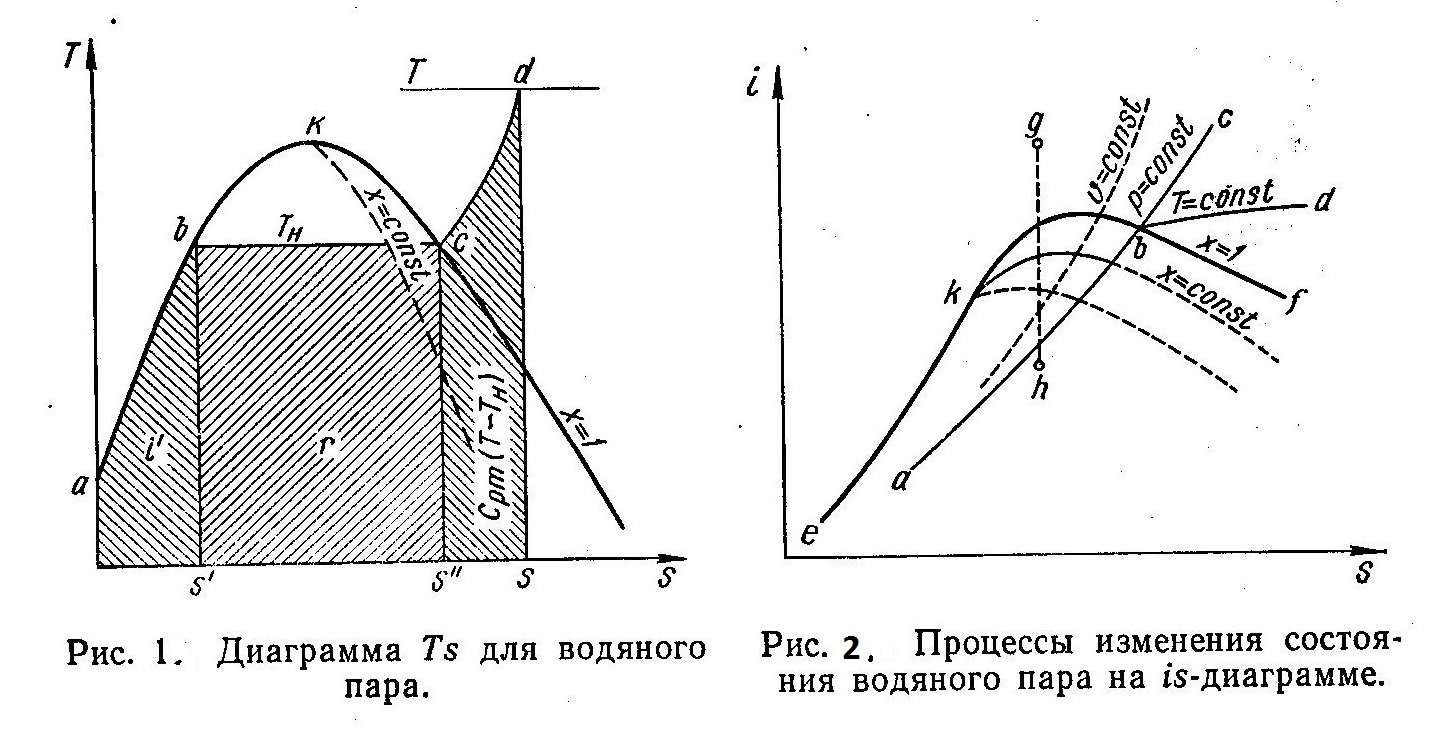
На рис. 1 в координатах Ts изображен процесс парообразования при р = const (процесс abcd). Кривая аКс является пограничной кривой, а точка К — критической точкой. Начало отсчета энтропии соответствует ее значению при 273 К. Площадь под кривой процесса на is-диаграмме соответствует количеству теплоты.
Следовательно, площадь под изобарой ab эквивалентна энтальпии воды i’ при температуре парообразования Tн. На изобарном участке bс, совпадающем с изотермой, происходит процесс парообразования, и площадь под прямой bс соответствует теплоте парообразования г. В изобарном процессе перегрева cd температура пара повышается до значения Т, и к пару подводится количество теплоты срm (Т—Тн). Линии постоянной степени сухости х=const, как и на всех диаграммах, сходятся в критической точке К.
На рис. 2 показаны различные процессы изменения состояния водяного пара на is-диаграмме. Область диаграммы, расположенная левее пограничной кривой еК, соответствует состоя-нию жидкости. Пограничная кривая пара Kf делит диаграмму на две области. Выше этой кривой расположена область перегретого пара, а ниже — область влажного пара. На пограничной кривой Kf пар является сухим насыщенным (х=1). Изобарный процесс изображен линией abc, изотермический — abd (в области влажного пара изотерма и изобара совпадают), изохорный — υ=const и адиабатный — gh. Кроме того, на этом рисунке показаны линии постоянной степени сухости х = const. В таблицах и на диаграммах не приводятся значения внутренней энергии газа, которую можно определить из соотношения u = i—pυ.
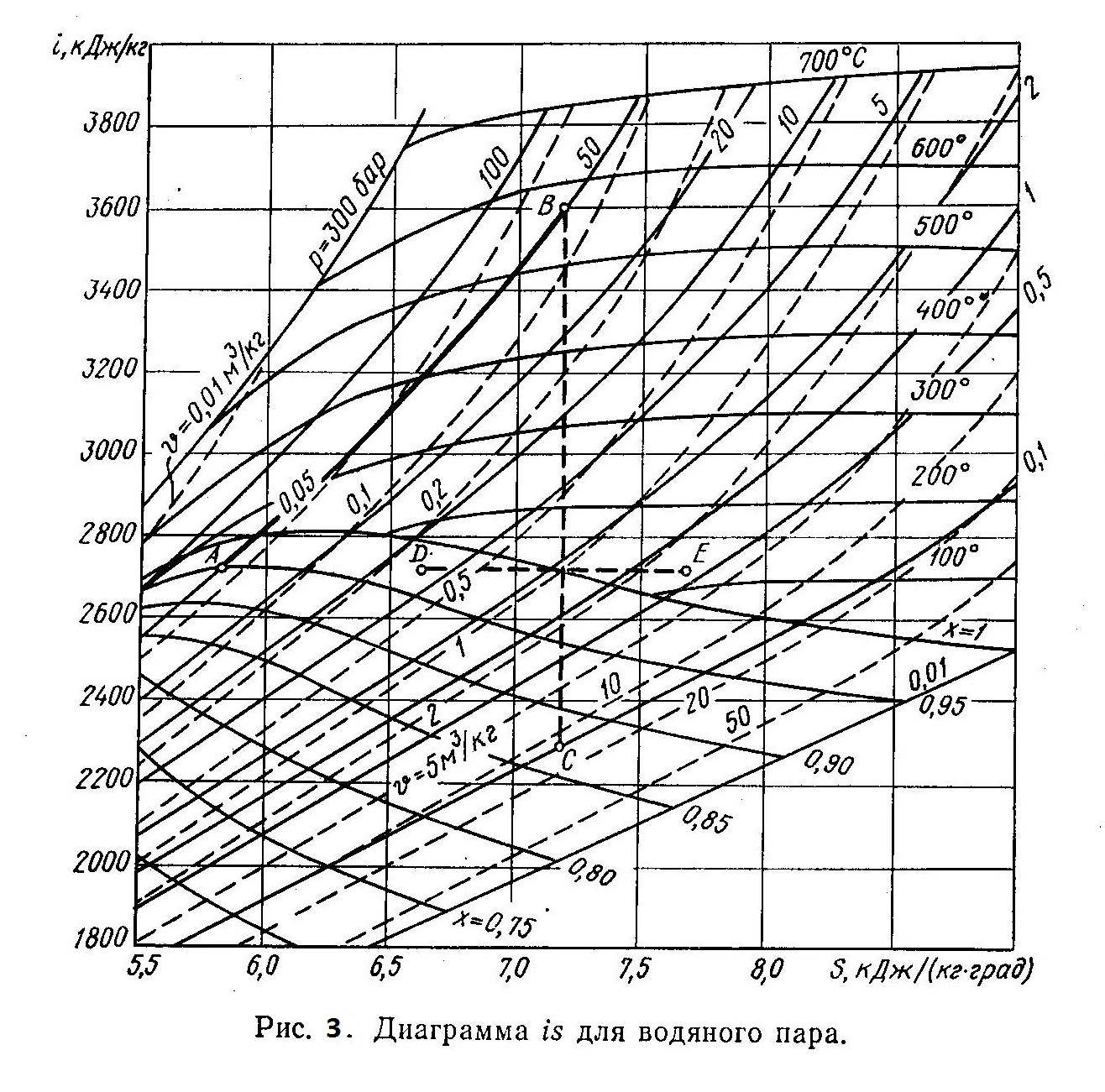
На рис. 3 приведена is-диаграмма водяного пара. При графическом расчете процессов по любым двум известным величинам (р, υ, Т; х, i, s) находят на диаграмме точку, соответствующую начальному состоянию пара, и все неизвестные параметры. Конечное состояние пара можно определить также по двум известным параметрам состояния. Если задан только один конечный параметр состояния, то необходимо знать еще характер процесса. В этом случае точку, характеризующую конечное состояние, находят на пересечении заданной кривой процесса и соответствующей изопараметрической кривой, например изобары.
Пример. Определить количество теплоты, сообщаемой 1 кг пара в пароперегревателе котельного агрегата. Начальные параметры пара p1 = 5 МПа и x1=0,95. Известно также, что после адиабатного расширения пара в турбине х2 = 0,87, а конечное давление пара р2=0,01 МПа.
Решение. Так как в пароперегревателе к пару подводится теплота при постоянном давлении, то количество ее равно разности начальной энтальпии i1 и энтальпии i2 пара после пароперегревателя: q=i2—i1. По начальным параметрам пара p1 и x1 на is-диаграмме находим точку А (рис. 3), которой соответствует значение энтальпии i1=2720 кДж/кг. Точку В, соответствующую состоянию пара на выходе из пароперегревателя, находим на пересечении изобары p1=5 МПа и адиабаты ВС, которая проходит через точку С. Положение точки С определяется параметрами пара р2 и x2. Энтальпия пара в точке В i2 = 3600 кДж/кг.
Количество подведенной к 1 кг пара теплоты равно q = 3600—2720=880 кДж/кг. Рассмотренный пример показывает, что is-диаграмма значительно упрощает расчеты процессов для водяного пара. Исп.литература: 1) Теплотехника и теплотехническое оборудование предприятий промышленности строительных материалов и изделий, Н.М. Никифорова, Москва, «Высшая школа», 1981. 2) Теплотехника, Бондарев В.А., Процкий А.Е., Гринкевич Р.Н. Минск, изд. 2-е,»Вышейшая школа», 1976.
Источник статьи: http://teplosniks.ru/texnicheskaya-termodinamika/diagrammy-vodyanogo-para.html
Диаграммы воды и водяного пара
Существует очень много способов показать зависимость одних параметров от других, но в то же самое время не все они понятны. Поэтому вполне логично определить, что таблица или график – это наиболее понятный способ донесения информации до человека. Подумать только, сколько всего было изобретено, но диаграммы, которые показывают различные зависимости параметров воды и водяного пара до сих пор эффективны. Как, например, таблица Вукаловича. Ведь ее создали почти пятьдесят лет назад, но пользуются ей до сих пор. И хотя для того, чтобы ее понимать и использовать ее для расчетов, требуется время и образование, все же она проще, чем какой-либо другой способ передачи информации.
А нужны ли таблицы и схемы?
Например, вода может переходить в состояние водяного пара только при 100 градусах по Цельсию. Так это или нет? Некоторые скажут, что да, и другого состояния быть не может. Не бывает такого, чтобы вода испарялась при температуре в 90 или 110 градусов. Однако надо брать в расчет еще и давление, при изменении которого серьезно изменяется и температура кипения воды. Чем давление выше, тем больше температура кипения, чем оно меньше, тем и температура ниже. Зависимость от стороннего параметра понятна тем, кто знает законы молекулярной физики. При этом плотность пара воды тоже подвержена изменениям.
Но все же есть еще множество разнообразных ситуаций, при которых таблица состояния перехода важна. Например, необходимость вскипятить воду в самолете при пониженном давлении в салоне требует особого отношения к жидкости. Не составляет труда понять, что и под землей, при более высоком давлении также нужно приложить больше усилий и передать большую энергию. Исходя из этого, диаграмма для водяного пара также меняется в зависимости от давления атмосферы.
Смотреть видео как работать с таблицей воды и водяного пара
Схема кислотности
Существует еще множество различных ситуаций, при которых появляется третий параметр, который в большой степени влияет на состояние жидкости или пара. Диаграмма кислотности воды (ph-баланса) в зависимости от энтальпии представляет собой достаточно сложную по своей структуре диаграмму. Чтобы разобраться в ней, придется немало посидеть над учебниками. Но понять зависимость все равно можно. Для пара подобной схемы нет, потому что кислотность водяного пара зависит от еще большего числа параметров (для этого надо вспомнить особенности очистки воды при испарении).
Таблица по жесткости

Причем, что очень интересно, такая система по-разному относится к воде со средней жесткостью. По самым «легким» стандартам средняя жесткость признается допустимой, тогда как по строгим критериям она не разрешена в домах вообще. С таблицей можно ознакомиться лично: в ней предлагаются довольно интересные параметры. Опять же: для водяного пара такой не существует, поскольку солей в паре крайне мало и смысл создания отсутствует.
В любом случае, как удалось сегодня выяснить, графиков и схем существует невероятное множество. Все они описывают оригинальное и необычное состояние жидкости в зависимости от множества ее параметров очень и очень подробно.
Источник статьи: http://voday.ru/agregatnye-sostoyaniya/par/diagrammy-vody-i-vodyanogo-para.html
Блог об энергетике
энергетика простыми словами
is (hs)-диаграмма состояния воды и водяного пара
Размер: 3070х3995 пикселей
Форматы: .PDF, .JPG
Диаграмма цветная — степени сухости, температура, давление и объем выделены разными цветами, что делает работу с диаграммой очень удобной.
Большой размер позволит распечатать диаграмму на формате А3 и больше.
is-диаграмма применяется для практических расчетов процессов водяного пара. На ней теплота и энтальпия измеряются линейными отрезками.
is-диаграмма обладает рядом важных свойств: по ней можно быстро определить параметры пара и разность энтальпий в виде отрезков, наглядно изобразить адиабатный процесс, и решать другие задачи.
Так же вы можете использовать очень удобную и наглядную программу.
Описание is-диаграммы
На is-диаграмме изображены термодинамические процессы:
- Изобарный процесс (p = const) — фиолетовые линии (изобары),
- Изотермический процесс (t = const) — зеленые линии (изотермы),
- Изохорный процесс (v = const) — красные линии (изохоры).
Степень сухости и паросодержание (х) — розовые линии. Жирная розовая линия — степень сухости х=1. Все что ниже этой линии — зона влажного пара.
Ось «Х» — энтропия, ось «Y» — энтальпия.
Семейство изобар в области насыщения представляет собой пучок расходящихся прямых, начинающихся на нижней и оканчивающихся на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой.
В i, s-диаграмме водяного пара наносятся также линии постоянного паросодержания (x = const) и линии постоянного удельного объема (v = const). Изохоры идут несколько круче, чем изобары.
Состояние перегретого пара обычно определяется в технике давлением p и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением p и паросодержанием x.
Точка, изображающее это состояние, определяется пересечением изобары и линии x = const.
Как пользоваться is-диаграммой
Для описания воспользуемся небольшой задачей. Возьмем с потолка условие.
Пусть начальные параметры пара будут: давление пара р = 120 бар, температура пара t = 550°С. Пар адиабатно расширяется в турбине до температуры, например, 400 °С.
Для примера этого будет достаточно.
Адиабатный процесс на is-диаграмме — это вертикальная линия (горизонтальная линия — дросселирование). Это для справки.
Итак, начальное давление и температура у нас есть. Найдем эту точку на is-диаграмме:
Нам нужна изобара, соответствующая давлению 120 бар и изотерма, соответствующая температуре 550 °С. На их пересечении и будет точка, соответствующая начальным параметрам пара в нашей задаче.
Найдя эту точку, мы уже можем определить в ней энтальпию и энтропию. Опустив на оси проекции найденной точки, узнаем значения энтальпии (ось «Y») и энтропии (ось «Х»).
3480 кДж/кг, S = 6,65 кДж/(кг•К)
Далее нам нужно узнать параметры пара после адиабатного расширения. Мы знаем, что по поставленным нами условиям, пар расширился и его температура в точке 2 = 400 °С. Я уже упоминал, что на is-диаграмме адиабатный процесс изображается в виде вертикальной линии. Проведем эту линию из точки 1 (начальные параметры) до пересечения с изотермой 400 °С.
Получена точка 2. Через эту точку проходит изобара. Она соответствует давлению 50 бар. Энтропия у нас не изменилась, так как процесс адиабатный, а вот энтальпия стала равна i = 3200 кДж/кг.
Вот и все. Дальше остаются только расчеты: определение изменения внутренней энергии (Δu), работы (l, l’) и т. д. Все это считается по формулам (формулы можете найти в статье «Основные термодинамические процессы»), а значения и график процесса расширения пара у вас уже есть.
Источник статьи: http://energoworld.ru/theory/is-diagramma-sostoyaniya-vody-i-vodyanogo-para/