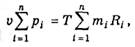Удельная газовая постоянная сухого пара
При температурах атмосферного воздуха 0-50 0 С парциальное давление водяного пара очень мало (0,006-0,07 бар), что позволяет применить к перегретому и сухому насыщенному водяному пару уравнение идеального газа:
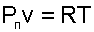 |
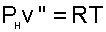 |
где РП, РН и v, v» — парциальные давления и удельные объемы для перегретого и сухого насыщенного водяного пара при температуре Т.
Разделив эти выражения друг на друга, получим расчетное выражение относительной влажности воздуха через парциальные давления водяного пара:
 |
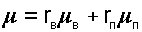 |
где rВ, rП — объемные доли сухого воздуха и водяного пара
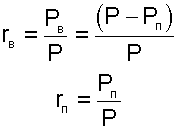 |
Р, РВ и РП— атмосферное и парциальные давления сухого воздуха и водяного пара;
μВ, μП — молярные массы сухого воздуха и водяного пара, μВ=28,96 кг/кмоль, μП=18,016 кг/кмоль.
В результате подстановки численных значений молярных масс сухого воздуха и водяного пара в выражение (8.6) получаем расчетное выражение молярной массы влажного воздуха в виде:
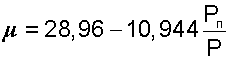 |
 |
она больше газовой постоянной сухого воздуха.
Плотность влажного воздуха определяется выражением:
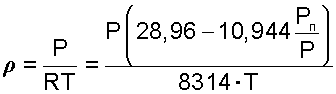 |
она меньше плотности сухого воздуха, т.е. влажный воздух легче сухого воздуха.
Влагосодержание d — это масса водяного пара в граммах, приходящаяся на 1 кг сухого воздуха. В общем случае понятие «влагосодержание» относится не только к паровой фазе воды, но и к жидкой, и к твердой ее фазам. Расчетное выражение для влагосодержания паровой фазы воды в воздухе (г/кг с.в.) получается из соотношения:
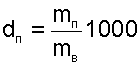 |
путем замены отношений масс на массовые доли и выражения последних через объемные доли, которые представляют отношения соответствующих парциальных давлений к давлению всей смеси:
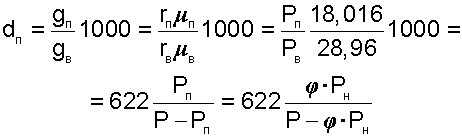 |
где gП, gВ — массовые доли пара и сухого воздуха,
rП, rВ — объемные доли пара и сухого воздуха.
Энтальпия влажного воздуха Н рассчитывается на 1 кг сухого воздуха (кДж/кг с.в.) и определяется как сумма энтальпий компонентов, находящихся в 1 кг сухого воздуха:
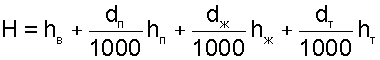 |
где dП, dЖ, dТ — количество пара, жидкости и твердой фазы Н2О (лед, снег) в граммах на килограмм сухого воздуха (влагосодержания);
hВ, hП, hЖ, hТ — удельные энтальпии сухого воздуха, пара, жидкости и твердой фазы Н2О, кДж/кг.
В выражении (8.12) энтальпии всех компонентов влажного воздуха необходимо подставлять при одинаковых давлениях и температурах начала их отсчета.
Для атмосферного влажного воздуха удельные энтальпии всех компонентов можно рассчитать, приняв ряд допущений, которые не приведут к погрешностям инженерных расчетов в диапазоне изменения атмосферного давления и температуры от -40 до 150 0 С более чем на 0,5 %.
Эти допущения сводятся к следующему. Начало отсчета удельной энтальпии сухого воздуха принимают при t0=0 0 С и считают, что энтальпия сухого воздуха зависит только от температуры (как для идеального газа), а его изобарная теплоемкость — величина постоянная. Расчетное выражение удельной энтальпии сухого воздуха в этом случае будет соответствовать соотношению
 |
где hВ0 = 0 начало отсчета энтальпии сухого воздуха при 0 0 С; cРВ = 1 кДж/(кг К) — изобарная теплоемкость идеального сухого воздуха, принята постоянной.
При таких допущениях удельная энтальпия сухого воздуха (кДж/кг) численно равна его температуре в градусах Цельсия:
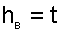 |
Для определения энтальпии воды и водяного пара начало отсчета внутренней энергии u0 = 0 принято при параметрах тройной точки воды t0=0,01 0 С и Р0=611,2 Па на линии насыщения х=0. При этих параметрах численное значение энтальпии h0‘ = P0v0‘ = 0,000611 кДж/кг представляет очень малую величину, которую для наших расчетов можно принять равной нулю. Таким образом, можно считать, что начало отсчета энтальпии H2О, как и сухого воздуха, ведется от 0 0 С и ее численное значение при этой температуре равно нулю (hП0=0).
Для дальнейшего пояснения определения энтальпии водяного пара рассмотрим изобару Р0, соответствующую тройной точке воды в Т,s- диаграмме (рис.8.2). Площадь ЕС11’0Е под изобарой Е-1 представляет в T,s- диаграмме теплоту изобарного процесса, состоящую из теплоты парообразования и теплоты перегрева пара, которая рассчитывается как разница энтальпий:
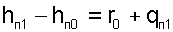 |
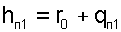 |
где r0= 2501 кДж/кг — теплота парообразования воды при 0 0 С,
qП1 — теплота перегрева пара от Т0 до Т.
Приняв изобарную теплоемкость перегретого пара величиной постоянной, cРП=1,93 кДж/(кг К), что допустимо для интервала температур атмосферного воздуха, получим расчетное выражение теплоты перегрева пара (кДж/кг):
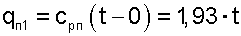 |
В результате этих преобразований расчетное выражение энтальпии водяного пара при температуре t и давлении тройной точки воды Р0 примет вид (кДж/кг)
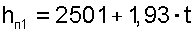 |
Этим выражением можно пользоваться и для расчета энтальпий пара при давлениях, отличных от давления тройной точки воды. Это объясняется тем, что при атмосферных условиях парциальные давления пара малы и близки к давлению тройной точки воды. При РП>Р0 (точка 2, рис.8.2) энтальпия пара будет представлять сумму трех слагаемых:
 |
где q’- изобарная теплота нагрева воды от 0 0 С до состояния насыщения (площадь ЕВВ’0Е).
Энтальпии пара hП соответствует площадь под изобарой Е-В-2. По сравнению с площадью под изобарой Е-1 здесь присутствует теплота q’, но величины r и qП уменьшились по сравнению с величинами r0 и qП1. При малых отклонениях изобар от изобары тройной точки воды в выражении hП по сравнению с выражением для hП1 будет происходить взаимная компенсация уменьшения величин r и qП за счет увеличения величины q’. В соответствии с рис. 8.2 эту взаимную компенсацию составляющих энтальпий hП и hП1 можно представить равенством площадей 11’2’D1 и 2DCЕВ2, т.е. будет справедливо равенство энтальпий hП1 и hП. На основании этого равенства получается расчетное выражение для энтальпии пара в атмосферном влажном воздухе:
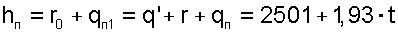 |
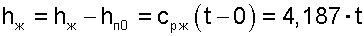 |
где сРЖ = 4,187 кДж/(кг К) — изобарная теплоемкость воды.
Для определения энтальпии твердой фазы воды (лед, снег) принимаются постоянными удельная теплота плавления льда и его изобарная теплоемкость. Эти величины берутся при параметрах тройной точки воды. Такие допущения возможны, поскольку в соответствии с Р,t- диаграммой для воды (рис.8.3) имеют место следующие факты:
1) в атмосферном воздухе твердая фазы воды (т.ф.) может присутствовать только при температурах и парциальных давлениях пара, меньших (или равных) температуры и давления тройной точки воды, т.к. только на линии сублимации АС возможно одновременное существование паровой и твердой фаз воды;
2) плавление льда в атмосферном воздухе возможно только при температуре 0 0 С;
3) переход льда в паровую фазу при температурах меньше 0 0 С происходит, минуя жидкую фазу воды, — по линии сублимации (АС);
4) парциальное давление водяного пара при отрицательных температурах атмосферного воздуха не намного меньше (или равно) давления тройной точки воды Р0, следовательно, теплота изобарного охлаждения твердой фазы воды от 0 0 С может быть рассчитана по изобаре Р0.
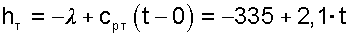 |
где λ = 335 кДж/кг — удельная теплота плавления льда при t=0 0 С,
сРТ = 2,1 кДж/(кг К) — изобарная теплоемкость льда; взята при давлении тройной точки воды и принята величиной постоянной.
В результате всех вышеприведенных упрощений окончательное расчетное выражение энтальпии влажного атмосферного воздуха (кДж/кг с.в.) примет вид
Источник статьи: http://ispu.ru/files/u2/book2/TD1_19-06/ttd8-2.htm
Уравнение состояния сухого воздуха
Состояние каждого из атмосферных газов характеризуется значениями трех величин: температуры, давления и плотности (или удельного объема). Эти величины всегда связаны между собой некоторым уравнением, которое носит название уравнения состояния газа.
Для каждого газа существует так называемая критическая температура Ткр. Если температура газа выше критической, то ни при каком давлении газ не может быть переведен в жидкое или твердое состояние, т. е. при Т > Ткр возможно только газообразное состояние вещества. Критические температуры атмосферных газов имеют следующие значения:
Из этих данных видно, что критические температуры всех атмосферных газов, кроме углекислого газа и водяного пара, очень низкие. Температуры, которые наблюдаются в атмосфере на всех высотах, значительно выше критических температур этих газов. Хотя критическая температура углекислого газа выше, чем обычно наблюдаемые температуры воздуха, этот газ далек от состояния насыщения, поскольку его парциальное давление в условиях атмосферы мало.
По своим физическим свойствам газ тем ближе к идеальному, чем выше его температура по сравнению с критической, а также чем меньше его давление по сравнению с давлением насыщения.
При условиях, наблюдающихся в атмосфере, основные газы, входящие в состав воздуха, ведут себя практически как идеальные газы. Поэтому уравнение состояния какого-либо газа имеет вид уравнения состояния идеального газа:
где pi — парциальное давление; Т — температура; Vi — удельный объем; Ri — удельная газовая постоянная i-гo газа; п — число газов, составляющих механическую смесь.
Удельная газовая постоянная Ri ; связана с универсальной газовой постоянной R * = 8,31441 103 Дж/(кмоль • К) следующим соотношением:
где μi — относительная молекулярная масса 1-го газа.
Согласно закону Дальтона, поведение каждого газа в механической смеси не зависит от присутствия других газов, а общее давление смеси равно сумме парциальных давлений, т. е.
Пусть масса сухого воздуха равна единице, а масса i-гo газа mi Тогда
где v— удельный объем сухого воздуха.
Подставляя vi в соответствии с (1.3.4) в формулу (1.3.1) и суммируя уравнения (1.3.1), получаем:
или, согласно (1.3.3),
где Rc — удельная газовая постоянная сухого воздуха:
Уравнение (1.3.5) и представляет собой уравнение состояния сухого воздуха.
Таким образом, уравнение состояния сухого воздуха имеет тот же вид, что и уравнение состояния идеального газа. При этом удельная газовая постоянная воздуха определяется как среднее взвешенное из парциальных газовых постоянных по формуле (1.3.6).
С учетом формулы (1.3.2) и данных о составе воздуха (см. п. 1.1) получаем следующее значение удельной газовой постоянной сухого воздуха:
Относительную молекулярную массу сухого воздуха по углеродной шкале можно получить при известных Rc и R*по соотношению
Если вместо удельного объема v в уравнение (1.3.5) ввести плотность р, связанную с v соотношением р = l/v, то оно примет вид
Наряду с таким видом уравнения состояния широкое распространение, особенно при изучении верхних слоев атмосферы, получила другая форма записи его. Эта форма легко получается из уравнения (1.3.5), если левую и правую части его умножить на μс:
где V = μсv объем моля воздуха. При фиксированных р и Т объем V, согласно (1.3.9), для всех газов одинаков. Например, при Т = О °С и р = 1013,2 гПа объем Vo = 22,41 м3/кмоль.
Если теперь разделить левую и правую части (1.3.9) на число молекул воздуха в одном моле (N), то получим:
Поскольку число молекул в одном моле — число Авогадро — для всех газов одинаково (N = 6,02 • 1026 кмоль»1), то величина к представляет собой тоже универсальную постоянную, называемую постоянной Больцмана:
Следовательно, уравнение состояния воздуха, равно как и любого другого газа, можно записать также в следующем виде:
где п = N/V — число молекул воздуха в 1 м3, которое, как следует
ИЗ (1.3.12), При фиксированных р и Т одинаково для всех газов: при Т = 0 º С и р = 1013,2 гПа, п = 2,687 · 10 25 м -3 .
Из уравнений (1.3.8) и (1.3.12) следует
где m=μс / N — средняя масса одной молекулы воздуха.
Источник статьи: http://mydocx.ru/9-112341.html