Исследование кривой насыщения влажного пара
Цель работы: изучить pv— и Ts-диаграммы водяного пара, изучить процессы фазового перехода; ознакомиться с понятием теплоты парообразования и ее свойствами; ознакомиться с кривой насыщения и уравнением Клапейрона-Клаузиуса.
Задание:
1. Провести опыты по исследованию кривой насыщения воды и водяного пара, т.е. зависимость 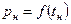
2. На основе результатов измерений рассчитать величину теплоты парообразования r, ее составляющих 
3. Составить отчет о выполненной работе, который должен содержать: основы теории (кратко), схему экспериментальной установки, таблицу измерений и результаты обработки опытных данных, а также график, выполненный на миллиметровой бумаге.
Основы теории
Процессы парообразования и конденсации широко распространены в химической технологии. Важной теплофизической характеристикой при расчете процессов перегонки, выпарки, ректификации, кипения и сушки является теплота парообразования r.
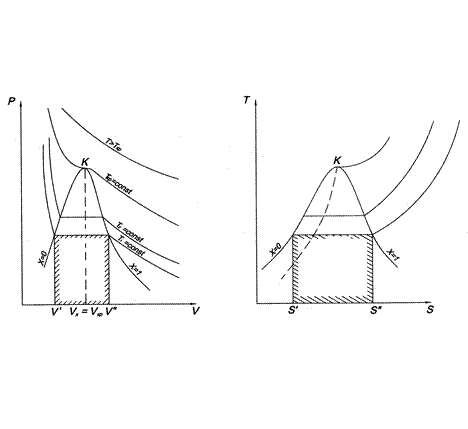
Для исследования термодинамических процессов, происходящих с реальными газами, большое значение имеют pv— и Ts-диаграммы (рис. 1 и 2).
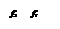 | |
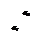 | |
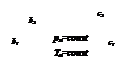 | |
 | |
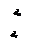 | |
| |
| |
| |
|
| |
 | |
 | |
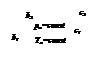 | |
|
На обеих диаграммах точки b1, b2,… соответствуют началу процесса парообразования и образуют нижнюю пограничную кривую – кривую кипящей жидкости (х = 0). На этих же диаграммах в точках с1, c2,… процесс парообразования завершается и данные точки образуют верхнюю пограничную кривую, соответствующую сухому насыщенному пару (х = 1). Точки d1, d2,… (рис. 1) и f1, f2,… (рис. 2) соответствуют состоянию перегретого пара, а точка а – жидкости. Степень сухости:
х = 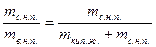
где 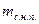


|
На участках b1c1, b2c2,…, где происходит переход жидкости в пар, в равновесии находятся системы, состоящие из двух фаз (двух агрегатных состояний) – жидкой и парообразной, причем температура и давление этих фаз одинаковы. Участки b1c1, b2c2,… на обеих диаграммах являются одновременно изобарой и изотермой, т.е. переход жидкости в пар совершается при рн = const, tн = const.
Таким образом, на обеих диаграммах можно выделить три характерные области состояний:
· область жидкого состояния – расположена левее кривой кипящей жидкости х = 0, t tн при данном давлении.
Переход вещества из одной фазы в другую называется фазовым переходом. Вещества, находящиеся в разных агрегатных состояниях, имеют различные физические свойства. Это различие объясняется характером межмолекулярного взаимодействия.
Количество теплоты, которое необходимо подвести к 1 кг жидкости для перехода её в пар в изобарно-изотермическом (рн и tн = const) процессе называется теплотой парообразования r, кДж/кг. Она расходуется на работу расширения 
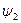
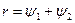
где 
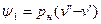
где 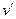
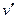
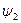
На pv-диаграмме (рис. 1), как следует из уравнения (2), величина 
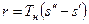
где 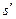
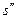
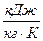
Тн — температура насыщения, К.
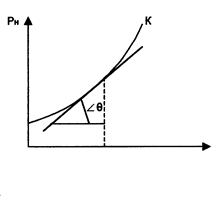
Из pv- и Тs-диаграмм видно, что с увеличением давления р точки b1, b2,… на нижней пограничной кривой сближаются с точками с1, с2, …на верхней пограничной кривой и в критической точке они сходятся. Так, для воды критические параметры в точке К имеют следующие значения: ркр. = 22,13 МПа, tкр. = 374,2 °С, vкр. = 0,00326 м 3 /кг.
Выше критической точки К при p > pкр. и Т > Ткр. двухфазного состояния не наблюдается. Жидкая фаза находится под весьма большим внутренним давлением. Фактором, определяющим интенсивность межмолекулярных взаимодействий, является не давление, а температура. С ростом температуры и давления теплота парообразования r уменьшается, а в критической точке r = 0, 
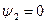


|
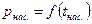
|

|

|
Связь между температурой и давлением насыщения выражается уравнением Клапейрона-Клаузиуса.

где 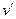
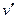
Поскольку 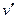
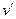
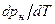
Уравнение Клапейрона-Клаузиуса (4) имеет важные достоинства. Во-первых, оно устанавливает связь между калорическими 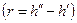

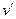

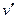
Первое из этих достоинств уравнения (4) в данной работе используется для определения теплоты парообразования r по кривой насыщения, полученной по результатам измерения термодинамических параметров рн и tн.
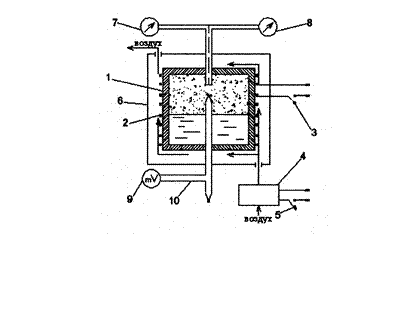
Проведение опытов
|
|
|
| |

|

где V — внутренний объем сосуда, м 3 ;
т — масса системы «жидкость-пар», кг;
vкр — удельный объем системы в критической точке, м 3 /кг.
При изохорном (v = vx = const) электрическом нагревании система «жидкость-пар» проходит ряд равновесных двухфазных состояний до критической точки К (на рис. 1 и 2 процесс изображен пунктирными линиями). В опыте измеряются избыточные давления манометром 7. Соответствующие температуры насыщения tн устанавливаются по измеренным значениям э.д.с. дифференциальных термопар.
Порядок работ следующий:
1. Установка включается преподавателем;
2. Измерения начинать по достижении показания манометра 5 делений и далее через каждые 5 делений. Одновременно с показаниями манометра в таблицу 1 записывать показания э.д.с. термопары е, мВ, измеряемые милливольтметром 9.
3. По достижении показаний манометра 50 делений показать результаты преподавателю.
4. Определить температуру окружающей среды tокр и атмосферное давление В. Заполнить таблицу 1.
5. С разрешения преподавателя установку можно отключить.
| ризб. | рн, МПа | е, мВ |  , °С , °С | tокр, °С | tн, °С | В, мм рт. ст. |
| делений | кгс/см 2 | |||||
 , °С , °С | Дата и подпись преподавателя: |
Источник статьи: http://poisk-ru.ru/s5509t4.html