Молярная масса влажного водяного пара
При температурах атмосферного воздуха 0-50 0 С парциальное давление водяного пара очень мало (0,006-0,07 бар), что позволяет применить к перегретому и сухому насыщенному водяному пару уравнение идеального газа:
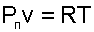 |
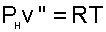 |
где РП, РН и v, v» — парциальные давления и удельные объемы для перегретого и сухого насыщенного водяного пара при температуре Т.
Разделив эти выражения друг на друга, получим расчетное выражение относительной влажности воздуха через парциальные давления водяного пара:
 |
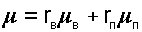 |
где rВ, rП — объемные доли сухого воздуха и водяного пара
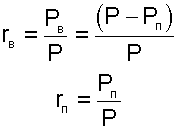 |
Р, РВ и РП— атмосферное и парциальные давления сухого воздуха и водяного пара;
μВ, μП — молярные массы сухого воздуха и водяного пара, μВ=28,96 кг/кмоль, μП=18,016 кг/кмоль.
В результате подстановки численных значений молярных масс сухого воздуха и водяного пара в выражение (8.6) получаем расчетное выражение молярной массы влажного воздуха в виде:
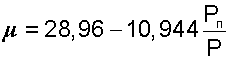 |
 |
она больше газовой постоянной сухого воздуха.
Плотность влажного воздуха определяется выражением:
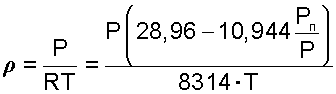 |
она меньше плотности сухого воздуха, т.е. влажный воздух легче сухого воздуха.
Влагосодержание d — это масса водяного пара в граммах, приходящаяся на 1 кг сухого воздуха. В общем случае понятие «влагосодержание» относится не только к паровой фазе воды, но и к жидкой, и к твердой ее фазам. Расчетное выражение для влагосодержания паровой фазы воды в воздухе (г/кг с.в.) получается из соотношения:
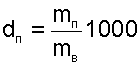 |
путем замены отношений масс на массовые доли и выражения последних через объемные доли, которые представляют отношения соответствующих парциальных давлений к давлению всей смеси:
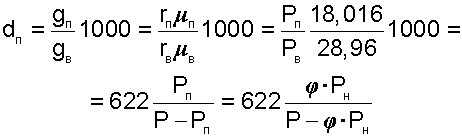 |
где gП, gВ — массовые доли пара и сухого воздуха,
rП, rВ — объемные доли пара и сухого воздуха.
Энтальпия влажного воздуха Н рассчитывается на 1 кг сухого воздуха (кДж/кг с.в.) и определяется как сумма энтальпий компонентов, находящихся в 1 кг сухого воздуха:
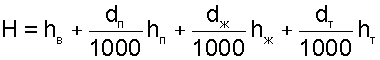 |
где dП, dЖ, dТ — количество пара, жидкости и твердой фазы Н2О (лед, снег) в граммах на килограмм сухого воздуха (влагосодержания);
hВ, hП, hЖ, hТ — удельные энтальпии сухого воздуха, пара, жидкости и твердой фазы Н2О, кДж/кг.
В выражении (8.12) энтальпии всех компонентов влажного воздуха необходимо подставлять при одинаковых давлениях и температурах начала их отсчета.
Для атмосферного влажного воздуха удельные энтальпии всех компонентов можно рассчитать, приняв ряд допущений, которые не приведут к погрешностям инженерных расчетов в диапазоне изменения атмосферного давления и температуры от -40 до 150 0 С более чем на 0,5 %.
Эти допущения сводятся к следующему. Начало отсчета удельной энтальпии сухого воздуха принимают при t0=0 0 С и считают, что энтальпия сухого воздуха зависит только от температуры (как для идеального газа), а его изобарная теплоемкость — величина постоянная. Расчетное выражение удельной энтальпии сухого воздуха в этом случае будет соответствовать соотношению
 |
где hВ0 = 0 начало отсчета энтальпии сухого воздуха при 0 0 С; cРВ = 1 кДж/(кг К) — изобарная теплоемкость идеального сухого воздуха, принята постоянной.
При таких допущениях удельная энтальпия сухого воздуха (кДж/кг) численно равна его температуре в градусах Цельсия:
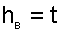 |
Для определения энтальпии воды и водяного пара начало отсчета внутренней энергии u0 = 0 принято при параметрах тройной точки воды t0=0,01 0 С и Р0=611,2 Па на линии насыщения х=0. При этих параметрах численное значение энтальпии h0‘ = P0v0‘ = 0,000611 кДж/кг представляет очень малую величину, которую для наших расчетов можно принять равной нулю. Таким образом, можно считать, что начало отсчета энтальпии H2О, как и сухого воздуха, ведется от 0 0 С и ее численное значение при этой температуре равно нулю (hП0=0).
Для дальнейшего пояснения определения энтальпии водяного пара рассмотрим изобару Р0, соответствующую тройной точке воды в Т,s- диаграмме (рис.8.2). Площадь ЕС11’0Е под изобарой Е-1 представляет в T,s- диаграмме теплоту изобарного процесса, состоящую из теплоты парообразования и теплоты перегрева пара, которая рассчитывается как разница энтальпий:
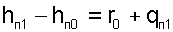 |
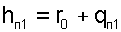 |
где r0= 2501 кДж/кг — теплота парообразования воды при 0 0 С,
qП1 — теплота перегрева пара от Т0 до Т.
Приняв изобарную теплоемкость перегретого пара величиной постоянной, cРП=1,93 кДж/(кг К), что допустимо для интервала температур атмосферного воздуха, получим расчетное выражение теплоты перегрева пара (кДж/кг):
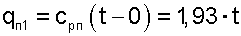 |
В результате этих преобразований расчетное выражение энтальпии водяного пара при температуре t и давлении тройной точки воды Р0 примет вид (кДж/кг)
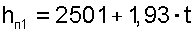 |
Этим выражением можно пользоваться и для расчета энтальпий пара при давлениях, отличных от давления тройной точки воды. Это объясняется тем, что при атмосферных условиях парциальные давления пара малы и близки к давлению тройной точки воды. При РП>Р0 (точка 2, рис.8.2) энтальпия пара будет представлять сумму трех слагаемых:
 |
где q’- изобарная теплота нагрева воды от 0 0 С до состояния насыщения (площадь ЕВВ’0Е).
Энтальпии пара hП соответствует площадь под изобарой Е-В-2. По сравнению с площадью под изобарой Е-1 здесь присутствует теплота q’, но величины r и qП уменьшились по сравнению с величинами r0 и qП1. При малых отклонениях изобар от изобары тройной точки воды в выражении hП по сравнению с выражением для hП1 будет происходить взаимная компенсация уменьшения величин r и qП за счет увеличения величины q’. В соответствии с рис. 8.2 эту взаимную компенсацию составляющих энтальпий hП и hП1 можно представить равенством площадей 11’2’D1 и 2DCЕВ2, т.е. будет справедливо равенство энтальпий hП1 и hП. На основании этого равенства получается расчетное выражение для энтальпии пара в атмосферном влажном воздухе:
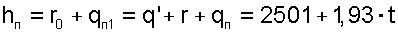 |
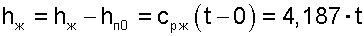 |
где сРЖ = 4,187 кДж/(кг К) — изобарная теплоемкость воды.
Для определения энтальпии твердой фазы воды (лед, снег) принимаются постоянными удельная теплота плавления льда и его изобарная теплоемкость. Эти величины берутся при параметрах тройной точки воды. Такие допущения возможны, поскольку в соответствии с Р,t- диаграммой для воды (рис.8.3) имеют место следующие факты:
1) в атмосферном воздухе твердая фазы воды (т.ф.) может присутствовать только при температурах и парциальных давлениях пара, меньших (или равных) температуры и давления тройной точки воды, т.к. только на линии сублимации АС возможно одновременное существование паровой и твердой фаз воды;
2) плавление льда в атмосферном воздухе возможно только при температуре 0 0 С;
3) переход льда в паровую фазу при температурах меньше 0 0 С происходит, минуя жидкую фазу воды, — по линии сублимации (АС);
4) парциальное давление водяного пара при отрицательных температурах атмосферного воздуха не намного меньше (или равно) давления тройной точки воды Р0, следовательно, теплота изобарного охлаждения твердой фазы воды от 0 0 С может быть рассчитана по изобаре Р0.
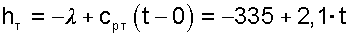 |
где λ = 335 кДж/кг — удельная теплота плавления льда при t=0 0 С,
сРТ = 2,1 кДж/(кг К) — изобарная теплоемкость льда; взята при давлении тройной точки воды и принята величиной постоянной.
В результате всех вышеприведенных упрощений окончательное расчетное выражение энтальпии влажного атмосферного воздуха (кДж/кг с.в.) примет вид
Источник статьи: http://ispu.ru/files/u2/book2/TD1_19-06/ttd8-2.htm
Молярная масса водяного пара
Молярная масса водяного пара
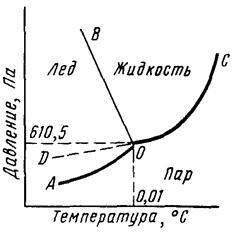
Он не имеет ни цвета, ни вкуса, ни запаха. Вода – это наиболее распространенное вещество в природе. Помимо существования в виде газа, она также может находиться в жидком или твердом (лед) состоянии, каждое из которых определяется температурой и давлением (рис. 1).
Рис. 1. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Брутто-формула водяного пара совпадает с брутто-формулой воды и имеет вид 2O. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(H2O) = 2×1 + 16 = 2 + 16 = 18.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что молярная масса водяного пара равна 18 г/моль.
Примеры решения задач
| Задание | Сколько граммов цинка вступило в реакцию взаимодействия с соляной кислотой, если образовалось 0,5 г газа водорода? |
| Решение | Запишем уравнение реакции взаимодействия цинка с соляной кислотой: |
Найдем молярную массу молекулярного водорода (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (H2) = 2×Ar(H) = 2×1 = 2 г/моль.
Рассчитаем количество вещества водорода:
Согласно уравнению реакции n(H2) :n(Zn) = 1 : 1, значит, n(Zn) = 1 моль.
Найдем молярную массу цинка (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (Zn) = 65 г/моль.
Определим массу цинка:
m(Zn) = n (Zn) × M (Zn);
m(Zn) = 1 × 65 = 65 г.
| Задание | Какая масса оксида меди (II) необходима, чтобы при восстановлении водородом получить из неё 128 г меди? |
| Решение | Запишем уравнение реакции восстановления оксида меди (II) водородом: |
Найдем молярную массу меди (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (Cu) = 64 г/моль.
Рассчитаем количество вещества меди:
n(Cu)= 128/ 64 =2 моль.
Согласно уравнению реакции n(Cu) :n(CuO) = 1 : 1, значит, n(CuO) = 2 моль.
Найдем молярную массу оксида меди (II) (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CuO) = Ar(Cu) + Ar(O) = 64 + 16 = 80 г/моль.
Источник статьи: http://ru.solverbook.com/spravochnik/ximiya/molyarnaya-massa/molyarnaya-massa-vodyanogo-para/